2.大腸菌のポリアミン代謝系〜ポリアミン代謝とグルタチオン代謝の関係
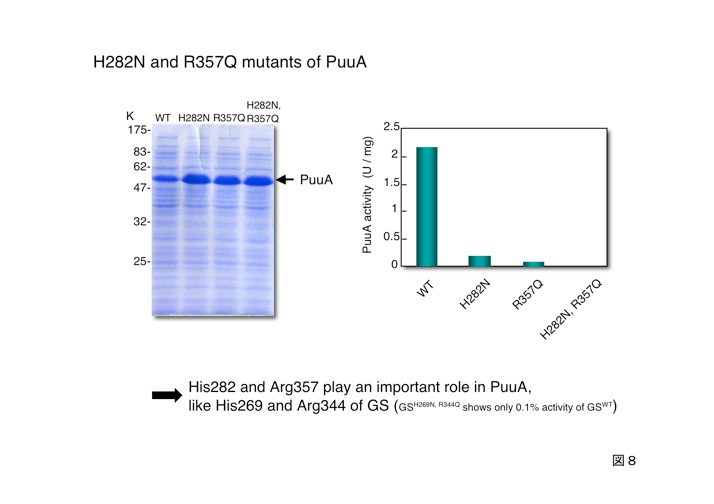
PuuAがプトレッシンをγ-グルタミル化できることをin vitroで確かめました。PuuAの触媒する反応とアミノ酸配列はグルタミン合成酵素に似ているため、その反応液組成を参考にして反応させました。その結果、図5に示すようにPuuA依存的にグルタミン酸とプトレッシンからγ-グルタミルプトレッシンが生成することが明らかとなりました。また、反応液からバッファー以外のいずれかを取り除くとγ-グルタミルプトレッシンは生成しませんでした。
このことから、PuuAはATP依存的にグルタミン酸のγ位のカルボキシル基とプトレッシンのアミノ基との間にアミド結合を形成するリガーゼであることが分かりました。図5の右下に示すようにPuuAの触媒する反応とグルタミン合成酵素が触媒する反応はよく似ています。
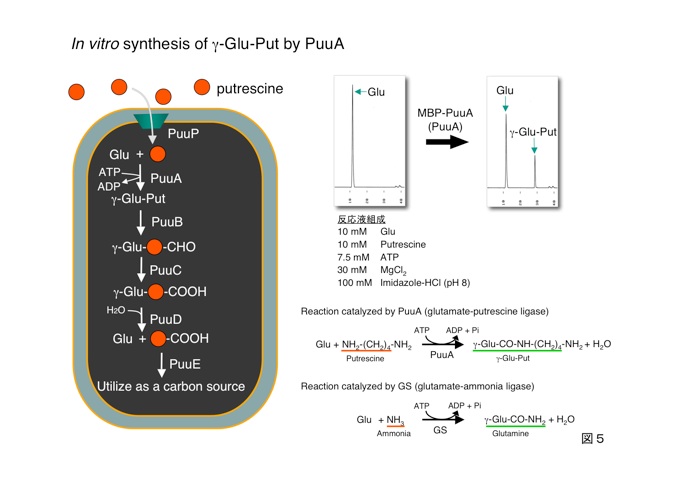
菌体をPuuA欠損にすると菌体内のポリアミン濃度はどうなるか調べました。
Aは野性型の菌体内のポリアミンを示しています。PuuAからEを欠損させると、Bに示すようにPuuPによって菌体外から取り込まれたプトレッシンのピークが見られました。プラスミドによりPuuAのみを補うと、Cに示すようにプトレッシンの蓄積量が減り、γ-グルタミルプトレッシンの大きなピークが現れました。
以上のことより、菌体外からプトレッシンが取り込まれたのち、先ずPuuAが働いて、プトレッシンをγ-グルタミル化していることが分かりました。
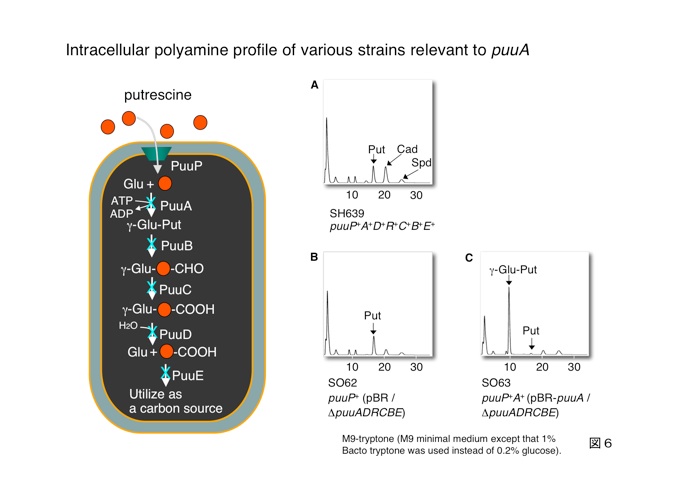
アミノ酸配列のblast検索をかけるとPuuAはグルタミン合成酵素と最も似ていることが分かりました。図7に示すように、グルタミン酸や金属イオンの結合サイトは良く保存されているものの、当然ながらグルタミン合成酵素のアンモニア結合サイトに当たるところ保存されておらず、そこはプトレッシンの結合サイトに変わっているためと考えられます。
GSのATP結合サイトにあるHis269とArg344に相当するアミノ酸残基は、PuuAでも保存されています。 GSのH269N変異酵素は野生型の3%、H269N, R344Q二重変異酵素は野生型のわずか0.1 %しか酵素活性がありません。
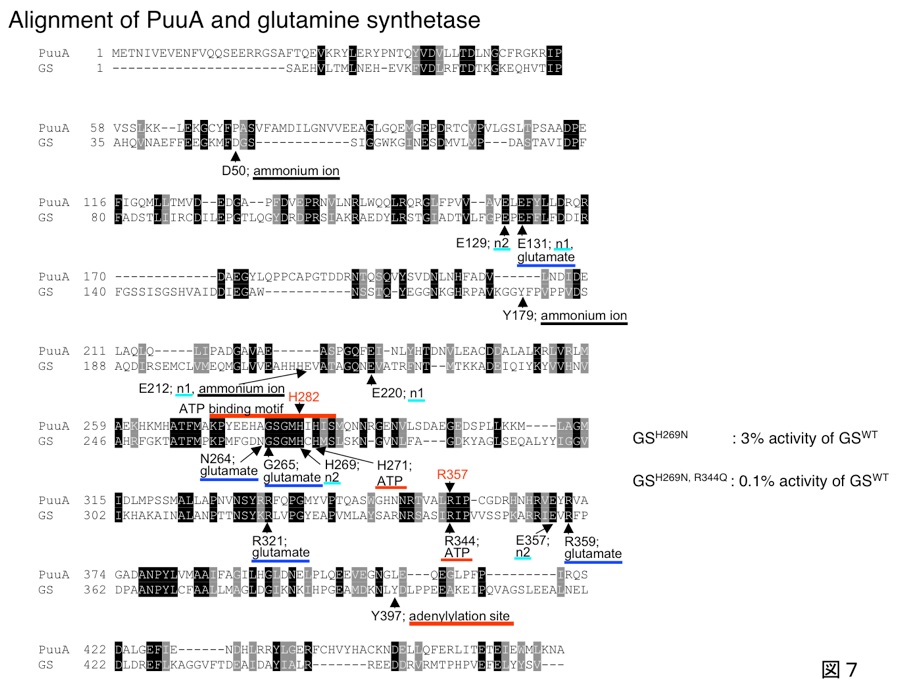
PuuAにこれらのアミノ酸置換に相当するH282NとR357Q変異を導入すると、この図8に示すように酵素活性の著しい低下が見られました。
これらHisとArg残基はPuuAでも活性に重要な役割を持っていると考えられます。