1-4.γ-グルタミルトランスペプチダーゼの自己触媒的プロセシング機構の解明
私たちがこれまでに明らかにしてきたGGTの性質から判断するとGGTはN-terminal nucleophile hydrolaseに属する酵素であると考えられます。N-terminal nucleophile hydrolaseスーパーファミリーに属する酵素は、前駆体として翻訳された後に、プロテオリティックなプロセシングにより成熟型酵素になる;そして、新しく生じたN末端のアミノ酸残基の側鎖が、酵素反応の際の求核原子になるという共通した性質があります。そして、このファミリーに属する酵素のうちの2つについては、自己触媒的にプロセシングすることが実験的に示されていました。
では、GGTの場合はどうなのでしょう。GGTは分子量4万の大サブユニットと分子量2万の小サブユニットからなるヘテロダイマー構造をしていますが、その遺伝子にはオープンリーシングフレームが1つしかありません。翻訳され、前駆体となった後、390番目のGlnと391番目のThrの間のペプチド結合が切断されることにより活性を持った成熟型のGGTになると考えられましたが、どのように切断されるかは分かっていませんでした。
GGTがN-terminal nucleophile hydrolaseスーパーファミリーに属する酵素であれば、GGTも自己触媒的に切断される可能性があります。それを実験的に確かめました。
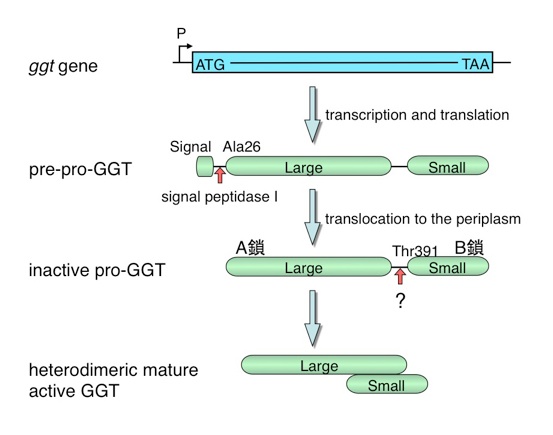
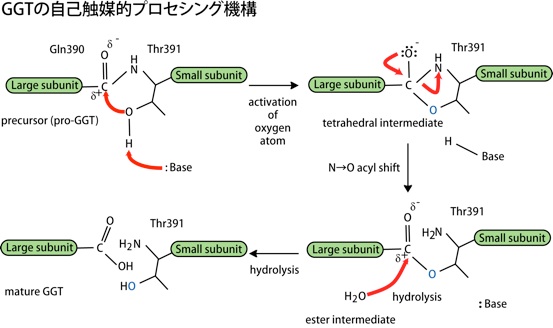
初めに生化学的な方法でプロセシング機構を調べたところ、塩基によって求核性が増したThr391の側鎖の酸素原子が直前のペプチド結合のカルボニルカーボンに求核付加し、正四面体型中間体を形成します。次に、N→Oアシルシフトが起こり、エステル中間体を形成します。エステル結合は不安定であるため、容易に加水分解を受け、前駆体が2つに分かれて成熟型酵素となるというものです。
このように、前駆体が自己触媒的にプロセシングすることを示したのはGGTでは初めてです。
参考文献
H. Suzuki, and H. Kumagai. Autocatalytic processing of γ-glutamyltranspeptidase. Journal of Biological Chemistry, 277(45), 43536-43543 (2002).
立体構造から分かったGGTの成熟化のメカニズム
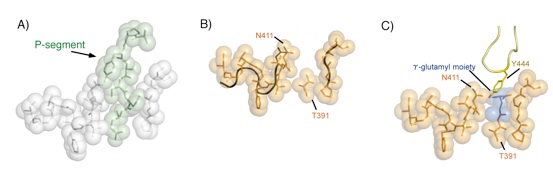
次に結晶構造から、プロセシング機構の詳細を調べました。大腸菌GGTの成熟体と前駆体をミミックしたGGTT391A変異体の立体構造を比較することにより以下のことが分かりました。
前駆体で触媒ポケットを含む分子表面にあるグルーブにはまり込んでいたP-セグメント(379〜390残基)は(図A)、Gln390とThr391間のペプチド結合が切断されると、触媒サイトから抜け出し、触媒ポケットを構成する左右の壁の間隔が1A以上も狭くなり、触媒ポケットは基質のγ-グルタミル基の大きさにフィットするサイズになります(図B)。さらに、γ-グルタミル中間体構造では前駆体でP-セグメントがあった場所にPro438~Gly449からなるループ(lid-loop)が触媒ポケットに覆い被さるように固定されます(図C)。プロセシングに伴い触媒ポケットの幅が変化するだけでなく、開閉自在の蓋つきポケットが形成されます。
プロセシングしないGGTT391A
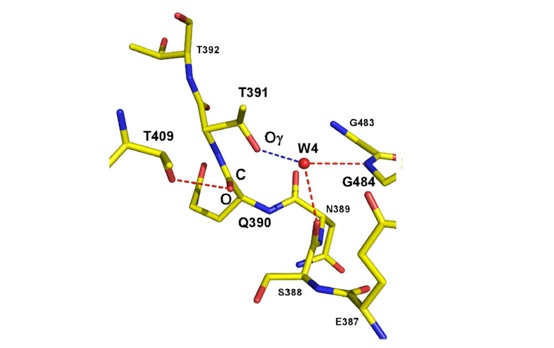
変異体の構造は野生型の前駆体構造をミミックしていると考えられます。GGTT391A変異体の結晶構造を基にAla391をThr391に置換し、野生型前駆体のプロセシング部位をモデリングしたところ。Thr391の側鎖のOγは、Gln390のカルボニル炭素をちょうど求核攻撃しやすい位置に配置することが予想されました。このOγは水分子(W4)との間で水素結合を作っており、さらにSer388とGly484とも水素結合を形成していました。この水分子が塩基となって活性化されたThr391のOγがGln390のカルボニル炭素に求核付加し、正四面体型中間体を経てN→Oアシルシフトによってエステル中間体となり、エステル結合が加水分解されてプロセシング反応が完了すると考えられます。
(結晶構造解析の研究は、大阪大学大学院理学研究科生物科学専攻の福山研究室との共同研究の成果です。)
参考文献
T. Okada, H. Suzuki, K. Wada, H. Kumagai, and K. Fukuyama. Crystal structures of γ-glutamyltranspeptidase from E. coli a key enzyme in glutathione metabolism, and its reaction intermediate. Proceedings of the National Academy of Sciences USA ,103, 6471-6476 (2006).
T. Okada, H. Suzuki, K. Wada, H. Kumagai, and K. Fukuyama. Crystal structure of the γ-glutamyltranspeptidase precursor protein fromEscherichia coli: Structural changes upon autocatalytic processing and implications for the maturation mechanism. Journal of Biological Chemistry,282, 2433-2439 (2007).
