1-3.γ-グルタミルトランスペプチダーゼの活性中心の解明
(この研究は京都大学化学研究所の平竹研究室との共同研究の成果です)
GGTは古くからセリンプロテアーゼに見られるような、アシル酵素中間体(この場合はγ-グルタミル酵素中間体)を形成すると考えられていました。多くの研究者が哺乳類のGGTの研究に取り組み、化学修飾法や部位特異的変異法を用いた研究が盛んに行われましたが、γ-グルタミル化される残基を特定することはできていませんでした。
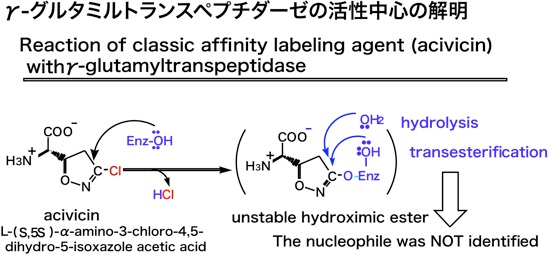
例えばここに代表的な例を示しますが、GGTの典型的なアフィニティーラベル化剤であるacivicinがGGTと作る結合は、不安定なhydroximic esterです。そのため、この結合が容易に加水分解されたり、酵素内の別のOH基に転位してしまい、acivicinが結合した残基が特定できないということが起こっていました。
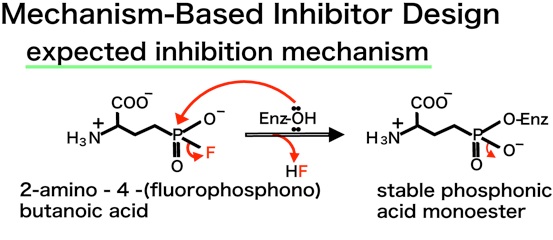
私たちは、京大化学研究所の平竹先生が開発された下図に示した化合物を用いることにしました。この化合物は低濃度でもGGTと反応して急速にGGTを失活させ、安定なホスホン酸モノエステルを形成しました。
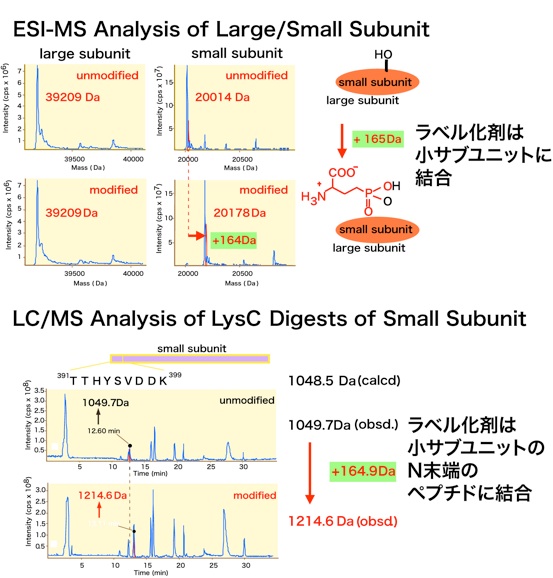
ラベル化剤で処理後、GGTを逆相HPLCで大小サブユニットに分離、MSを測定したところ、コントロールに比べ小サブユニットの質量数がラベル化剤1分子分増えていました。つまり、触媒残基は小サブユニットにあることが分かりました。小サブユニットをリシルエンドペプチダーゼで加水分解して、どのペプチド断片にこのラベル化剤が結合しているかをLC/MSで調べました。質量数1049.7ダルトンのピークだけが、修飾により質量数が増大していました。従って、ラベル化剤はN末端のペプチド断片に結合していることが分かりました。
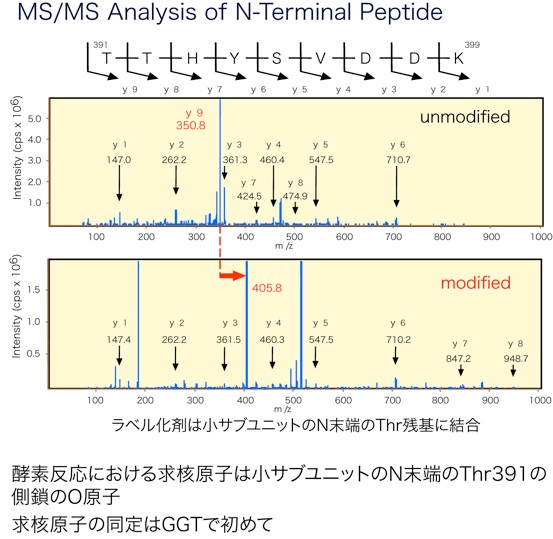
このピークを回収して、MS/MSにかけ、ちょうどペプチド結合の位置でフラグメンテーションを起こさせて分析したところ、N末端のThr残基が修飾されていること、つまり、酵素反応時に求核原子となるのは小サブユニットN末端のThr-391の側鎖のO原子であることが分かりました。
求核原子の同定は、GGTでは初めてのことでした。GGTは、大腸菌からヒトにいたるまで、良く似ていることから、ヒトのGGTの場合も小サブユニットN末端のThr残基が活性中心であろうと考えられます。
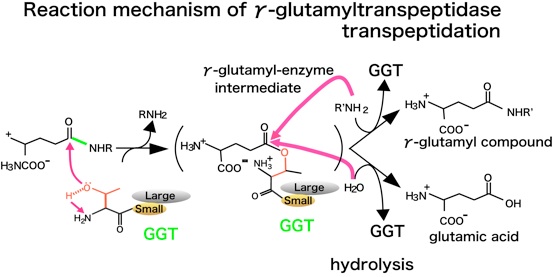
ここにGGTの反応機構をまとめました。
小サブユニットN末端のThr残基のα位のアミノ基が塩基として、側鎖のOH基のHを引っ張って酸素原子の求核性を増します。求核性が増したThr残基側鎖のO原子が、基質のカルボニルカーボンに求核付加して、このようなγ-グルタミル酵素中間体を形成します。アミノ酸などのアクセプターがこの中間体のカルボニルカーボンに求核付加すると新しいγ-グルタミル化合物を生成する転移反応となり、水が求核攻撃するとグルタミン酸を遊離する加水分解反応となります。
(GGTの求核原子を決めた研究は、京都大学化学研究所の平竹研究室との共同研究の成果です。)
参考文献
J. Hiratake, H. Suzuki, and H. Kumagai. γ-Glutamyltranspeptidase and its precursor. In Handbook of Proteolytic Enzymes. 2nd ed. Ed. by A. J. Barrett, N. D. Rawlings, and J. F. Woessner, Academic Press, Oxford, pp. 2090-2094 (2004).
鈴木秀之、熊谷英彦.γ-グルタミルトランスペプチダーゼ:Ntn-ヒドロラーゼスーパーファミリーの新しいメンバー.蛋白質核酸酵素,46(11), 105-111 (2001).
M. Inoue, J. Hiratake, H. Suzuki, H. Kumagai, and K. Sakata. Identification of catalytic nucleophile of Escherichia coliγ-glutamyltranspeptidase by γ-monofluorophosphono derivative of glutamic acid: N-terminal Thr-391 in small subunit is the nucleophile. Biochemistry, 39(26), 7764-7771 (2000).
GGTの3次元構造の解明
酵素反応における求核原子がT391残基の側鎖の酸素原子であることを生化学的方法で明らかにしていたものの、そのほかの活性にあずかる残基が何であるかについては不明でした。多くの報告のある哺乳類のGGTは膜結合酵素であり、不均一に糖鎖で修飾されているため、可溶性で均一な酵素標品を得ることは困難です。一方、大腸菌のタンパク質は糖鎖で修飾されることはなく、またGGTはペリプラズムに可溶性の状態で局在していることから、可溶性で均一な酵素を得ることが容易であるため、結晶構造解析を行う上で大腸菌のGGTは好都合でした。
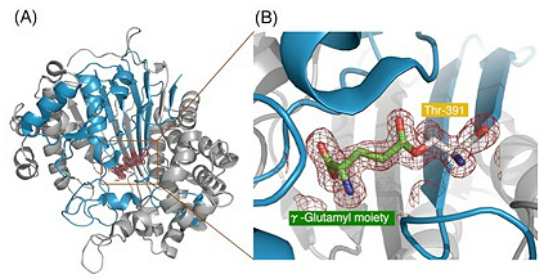
セレノメチオニンを取り込ませた大腸菌からGGTを精製し、MAD法で結晶構造解析を行い解像度1.95 Aで構造を決定できました。全体のフォールド構造はαββα構造をとっておりN-terminal nucleophile hydrolaseスーパーファミリーの典型的なトポロジーを持っていました。グルタチオンを含むcryoprotectant溶液に結晶をつけた後、速やかに100 Kの窒素ガスで凍結して構造解析に供したところ、グルタチオンはすでに加水分解され、γ-グルタミル酵素中間体の構造を決定することができました。生化学的な実験結果と同様、小サブユニットN末端のThr残基の側鎖の酸素原子がグルタミン酸のγ位の炭素に結合していました。
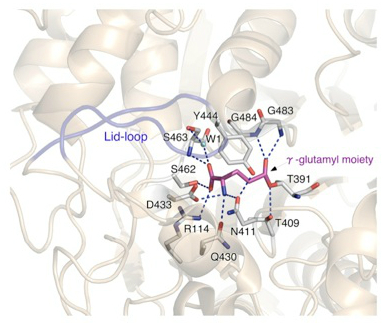
γ-グルタミル酵素中間体の状態で活性中心付近がどのような構造になっているかを次の図に示します。P438からG449のペプチド鎖部分がループ構造(lid-loopと)をとり、触媒ポケットを上から覆っていました。γ-グルタミル基との結合にあずかる残基を見ると、α-アミノ基はD433の他、N411やQ430とも水素結合を形成していました。また、R114、S462、S463が基質のα-カルボキシル基と水素結合していた。さらにG483とG484の主鎖のアミノ基がカルボニル炭素と水素結合しており、反応の遷移状態において正四面体型中間体を形成すると考えられました。
参考文献
鈴木秀之、和田啓、福山恵一 γ-グルタミルトランスペプチダーゼの立体構造に基づいた成熟化と酵素反応機構 蛋白質核酸酵素,54(3), 245-251 (2009).
T. Okada, H. Suzuki, K. Wada, H. Kumagai, and K. Fukuyama. Crystal structures of γ-glutamyltranspeptidase from E. coli a key enzyme in glutathione metabolism, and its reaction intermediate. Proceedings of the National Academy of Sciences USA, 103, 6471-6476 (2006).
