1-5-1-3.結晶構造解析の結果に基づいた変異の導入によりGGTのGL-7-ACAアシラーゼ活性を上昇させる
γ-グルタミル基の認識に関与する残基やlid-loopのフレキシビリティーに影響すると考えられるY444などに変異を導入することを考えました。
Y444残基への変異の導入
大腸菌のY444はN411との間で水素結合を形成することにより、lid-loopのコンフォメーションを固定しています。しかし、哺乳類のGGTはY444に相当する位置はPheであり、N411との間で水素結合を作らず、lid-loopはよりフレキシブルであると考えられます。このことが、哺乳類のGGTの比活性が大腸菌のものより数百倍高い理由の一つかもしれないと考えました。
そこで、D433Nに加えてY444に様々なアミノ酸置換を入れた変異型GGTの活性を見たところ、A, I, V, L, G, H, Aへの置換でD433N変異酵素に比べkcat値が高くなり、特にD433N Y444A酵素はkcat値が6倍近くに上昇し、かつKm値が小さくなったため、触媒効率を示すkcat/Km値はD433N酵素の43.5倍にも上昇しました。
基質のγ-グルタミル基のN411, Q430, D433残基への変異の導入と効果的スクリーニング
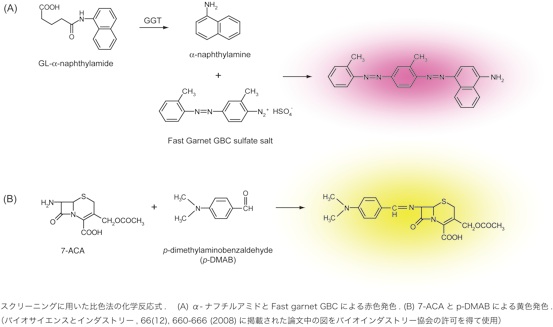
D433の他にN411, Q430もこのγ-グルタミル基のα-アミノ基とインタラクションしています。そこで、N411, Q430, D433の3つの残基を同時にランダムに置き換え、高いGL-7-ACAアシラーゼ活性を獲得した変異体を得ることを試みました。1次スクリーニングは、26,500株を化学合成したGL-α-ナフチルアミドを基質とし、遊離したα-ナフチルアミンがFast Garnet GBCとジアゾカップリング反応して少しでもコロニーが赤色となった178株を選択するという方法で行いました。
この変異操作に用いたプラスミド上のggt遺伝子は大サブユニットN末にHis-tagを付加した構造にしていたので、2次スクリーニングは178株からNiカラムを用いて酵素を精製し、GL-7-ACAを基質として反応させ、遊離した7-ACAをp-ジメチルアミノベンズアルデヒド(p-DMBA)と反応させて比色定量し、12株を選抜しました。その結果、N411はG, H, Yに、Q430はI, Lに、D433はG, A, Lに置き換わっていました。そこで、これら3残基の変異の組み合わせをすべてAmpsCamrであるpACYC184上にクローニングしたggt遺伝子に作り、ΔampC Δggt株を形質転換し、大腸菌由来の2つのβ-ラクタマーゼの影響を排除して菌体あたりのGL-7-ACAアシラーゼ活性をp-DMBA法で比較した。その結果、これら3残基の組み合わせ方によっては、GGTがGL-7-ACAアシラーゼ活性を持つためにD433N変異は必須ではないことが明らかとなりました。
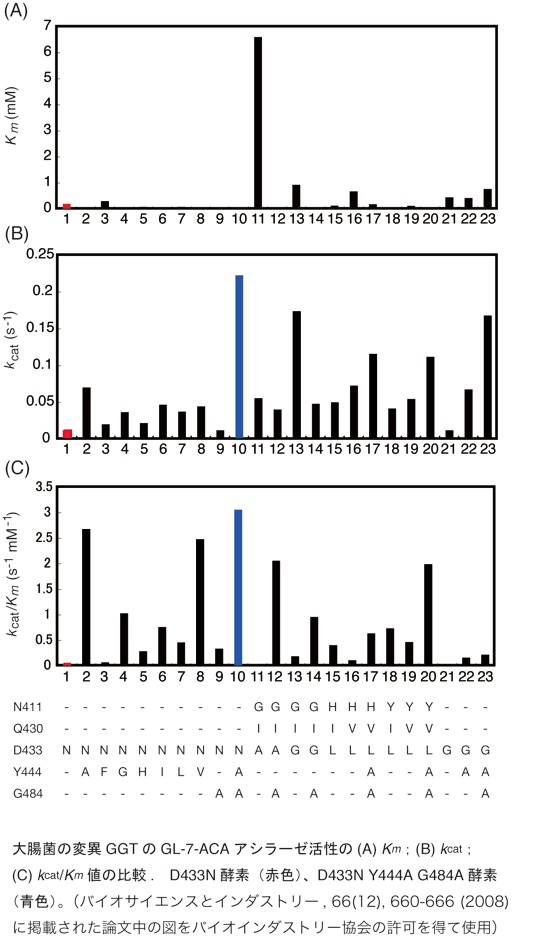
N411, Q430, D433残基の変異とY444A, G484A変異の組み合わせ
N411, Q430, D433残基の様々なアミノ酸置換の組み合わせにY444AとG484A変異を組み合わせた変異酵素を作製、精製してKm値とkcat値を測定しました。その結果、D433N Y444A G484A酵素が最も高いGL-7-ACAアシラーゼ活性を示し、kcat値はD433N酵素の18倍、触媒効率を示すkcat/Km値はD433N酵素の50倍にもなりました。
参考文献
鈴木秀之、和田啓、福山恵一. γ-グルタミルトランスペプチダーゼのグルタリル-7-アミノセファロスポラン酸アシラーゼへの変換〜立体構造に基づく効果的変異導入. バイオサイエンスとインダストリー,6612), 660-666 (2008).
C. Yamada, K. Kijima, S. Ishihara, C. Miwa, K. Wada, T. Okada, K. Fukuyama, H. Kumagai, and H. Suzuki. Improvement of the glutaryl-7-aminocephalosporanic acid acylase activity of a bacterial γ-glutamyltranspeptidase. Applied and Environmental Microbiology,74(11), 3400-3409 (2008).
