1-5-1-2.点突然変異によるγ-グルタミルトランスペプチダーゼのグルタリル-7-アミノセファロスポラン酸アシラーゼへの変換〜加水分解反応の抗生物質生産への応用
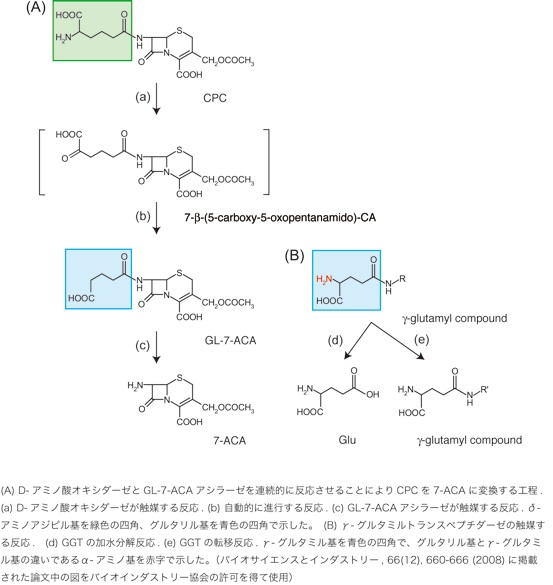
セファロスポリン系抗生物質は7-アミノセファロスポラン酸を出発原料として、その側鎖を化学修飾することにより合成されます。7-アミノセファロスポラン酸はカビの作るセファロスポリンCの7位の側鎖を脱アシル化することによって供給されています。現在、主として化学法によっていますが、数年前に図に示したように2つの酵素を連続的に反応させる方法が工業化されました。この反応で重要なグルタリル-7-アミノセファロスポラン酸アシラーゼはこれまでにいくつかのバクテリアにしか見つかっていません。
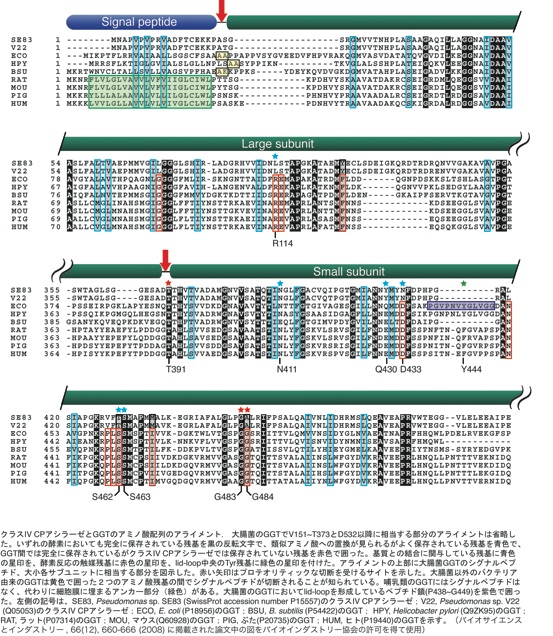
私たちはバクテリアのGGTの研究をしている過程で、GGTとグルタリル-7-アミノセファロスポラン酸アシラーゼ活性を持つ、クラスIVセファロスポリンアシラーゼの1次構造が非常に高いことに気づきました。色を付けた残基がこれまでにアミノ酸配列の分かっているGGT間で完全にあるいは極めてよく保存されている残基です。そのほとんどがクラスIVセファロスポリンアシラーゼでも保存されていました。赤字で示したものがGGTでは完全に保存されているけれども、クラスIVセファロスポリンアシラーゼでは保存されていない残基です。私たちはAsp433に注目しました。この残基はクラスIVセファロスポリンアシラーゼではAsnになっていました。
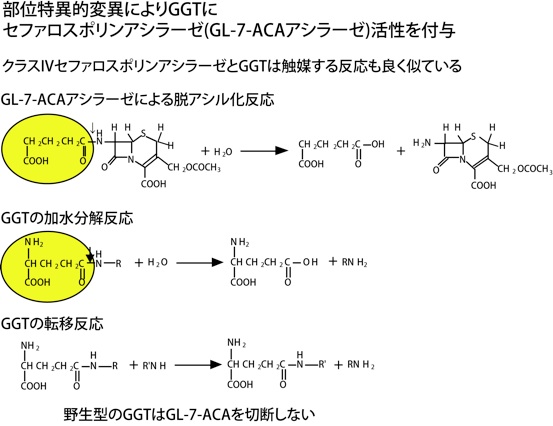
この図に示すように、グルタリル-7-アミノセファロスポラン酸アシラーゼの反応と、GGTの加水分解反応は極めて似たアミド結合の加水分解反応です。しかし、野性型のGGTにはこの活性はありません。両者の違いは基質に青字で示したグルタミン酸のα位のアミノ基があるかないかの違いです。このアミノ基とインタラクションしているのが、先ほどのAsp433だと考えられています。そこで、このAsp433をAsnに置き換えた変異酵素を作成しました。
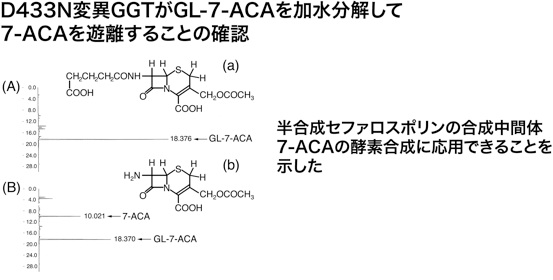
グルタリル-7-アミノセファロスポラン酸にD433N変異酵素を反応させると、7-アミノセファロスポラン酸が生成することが逆相HPLCで確認できました。さらに、この7-アミノセファロスポラン酸を精製してNMRで確認したところ、市販品とおなじパターンを示すことが分かり、確かに7-アミノセファロスポラン酸が生成していることが確認されました。