【有機金属化学を基盤とする有機合成法の開発】
vic−ジボリル化合物とジハロゲン化ビアリールとの二重交差カップリング反応による
多環芳香族炭化水素の効率合成
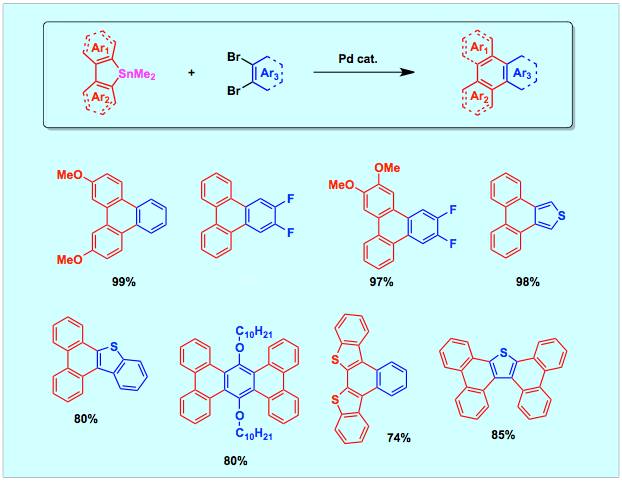
有機エレクトロニクスの進歩に伴い、ペンタセン,フルオレン,トリフェニレンなどに代表される多環芳香族炭化水素(Polycyclic Aromatic Hydrocarbon: PAH)の有用性が高まっています。機能分子の特性はその電子構造や分子凝集構造と密接に関係するので、官能基を有するPAHを効率よく合成する手法の開発は,縮合芳香環を基盤とする機能材料の創製を図る上でたいへん重要です。我々は、ジボリル化合物の高い官能基許容性に着目し、多官能性PAHの効率合成法として、ジボリル化合物とジハロゲン化物との二重交差カップリング反応の開発に取り組んでいます。最近,vic-ジボリルオレフィンやフェナントレンと2,2¢−ジブロモビアリールとが、パラジウム触媒存在下円滑に反応してさまざまな官能基が置換するフェナントレンやジベンゾ[g,p]クリセン誘導体が収率よく合成できることを明らかにしました。この反応を使うと、従来法では合成することが困難な誘導体をいくつも合成することが可能です。オルト置換ブロモベンゼンとの反応では、ジボリル化合物のほうが対応するモノボリル化合物よりも高い反応性を示すという興味深い知見も得ています。
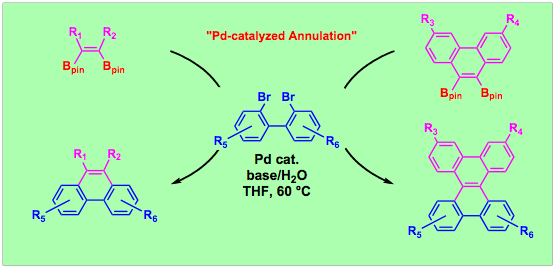
文献:Angew. Chem. Int. Ed. 2008, 47, 8096-8099; Tetrahedron 2011, 67, 8014-8026.
ジハロゲン化物として2,2′−ジブロモビアリールに代えて1−ブロモ−2−ブロモメチルアレーンを用いると対応する5員環形成反応が円滑に進行します。この反応により置換インデンやフルオレン誘導体やチオフェンやピリジンなどの複素環が縮合したシクロペンテン誘導体を簡便に合成することができます。
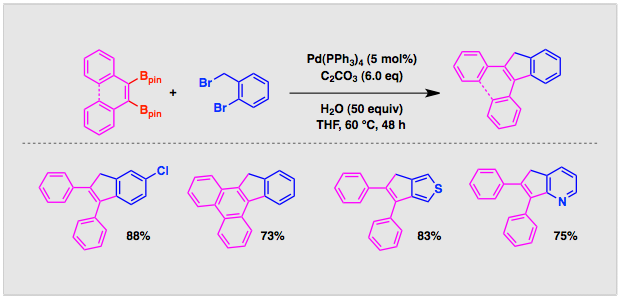
文献:Synlett 2009, 3147-3150.
さらに、1−ブロモ−2−(2−ブロモエテニル)アレーンと1,2-ジボリル反応剤との二重交差カップリングも開発しています。一般式は、多置換ナフタレンやフェナントレンの合成法を示していますが、求電子剤にジブロモビス(2−ブロモエテニル)アレーンを用いて環化を二重に行うと、ピセンやジベンゾアントラセンなどの拡張パイ電子系を一挙に構築することができます。
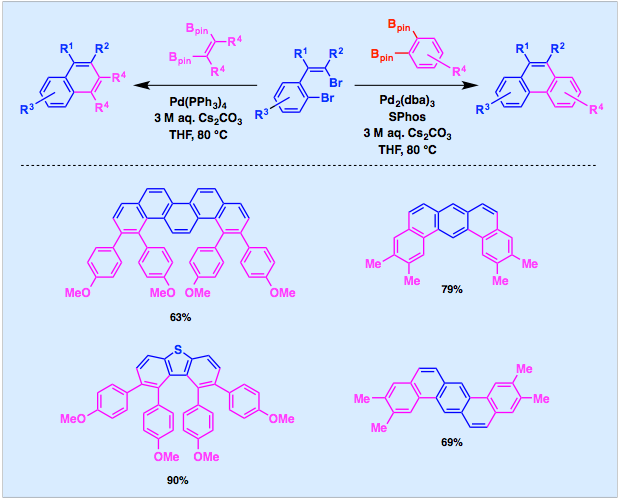
文献: Chem. Asian J. 2012, 7, 1644–1651.
パラジウム触媒を用いる9−スタンナフルオレンの二重交差カップリング反応による
縮合多環芳香族炭化水素の直截的合成
すでに紹介したvic−ジボリル化合物と2,2′−ジブロモビアリールとの二重交差カップリング反応は、1,2−ジメタル化合物と1,4−ジハロ化合物との[4+2]型環化反応 (mode A) です。一方、これを極性転換した1,2−ジハロ化合物と1,4−ジメタル化合物とのアニュレーション (mode B) もベンゼン環形成の戦略として魅力的です。なぜなら、1,4−ジメタル化合物は対応する1,4−ジハロ化合物から容易に調製でき、さらに入手可能な1,2−ジハロ化合物は1,2−ジメタル化合物よりもはるかに豊富だからです。
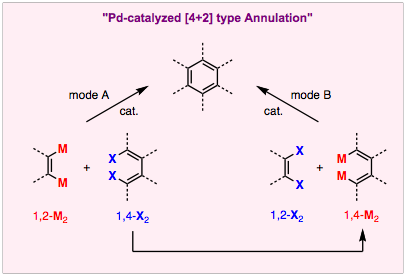
こうした観点から、われわれは9−スタンナフルオレンを1,4−ジメタル反応剤として利用することを着想しました。着想のきっかけは、(1)9−スタンナフルオレンは対応するジブロモ化合物から容易に調製できること、(2)ひずみのかかった環構造により高い反応性が期待できること、(3)対応する2,2′−ビス(スタニル)ビフェニル反応剤と比べて金属残渣が半分に減らせることに注目したからです。そして、パラジウム触媒としてPd(PtBu3)2を用いると、9−スタンナフルオレンと1,2−ジブロモアレーンのアニュレーションが効率よく進行して、多官能性トリフェニレンが高収率で合成できることを見つけました。ヘテロ環の縮合様式は、用いるジブロモ体の位置異性体(たとえばチオフェンの場合では、2,3−ジブロモ体および3,4−ジブロモ体)を使い分けることにより、容易に制御できることがこの手法の強みです。また、求電子剤にテトラブロモ体を選び環形成が起こるところを2カ所含むようにすると、拡張π電子系を一挙に構築することができます。現在この反応を利用して新しい機能材料の探索に取り組んでいます。
文献:Angew. Chem. Int. Ed. 2009, 48, 7573-7576.
スタンナフルオレンのカップリング相手には、1,1−ジボリル−1−アルケンを使うことも可能です。この反応ではフッ化セシウムの添加が必須です。この反応により、交差共役系分子であるジベンゾフルベン誘導体を高収率で得ることができます。
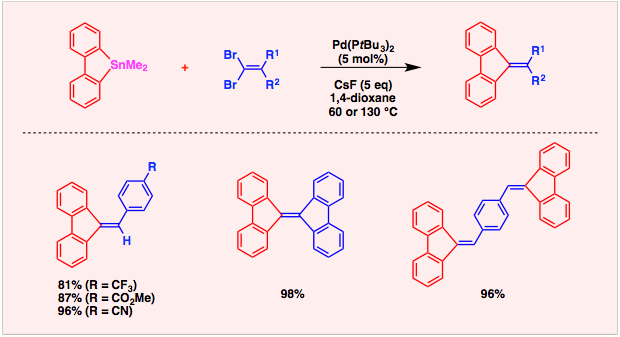
文献: Aust. J. Chem. 2012, 65, 1277-1284.
gem−シリルホウ素化およびジホウ素化反応の開発
金属二置換化合物は、単一の実験操作により炭素−炭素結合を一挙に二つ構築することができるのみならず、多官能性有機金属化合物の前駆体として利用することもできるので、高次構造の有機分子骨格を効率よく合成するための有機合成反応剤としてたいへん有用です。したがって、金属二置換化合物を簡便に合成する方法の開発はとても重要です。 我々は、ハロゲン化物1から発生させたリチウムカルベノイド3にシリルボランやジボロンを低温で作用させて対応するボラート錯体4を調製し、これを室温に昇温するとシリル基やボリル基の1,2−転位が進行してgem−シリルボリル化合物2 (M = Si) やジボリル化合物2 (M = B) が収率よく生成することを見つけました。この反応を用いることにより、さまざまな種類の二金属化合物を効率よく合成することができます。また、合成したジボリル化合物を使って、ジボリルブタジエンやテトラボリル−2−ブテンの簡便合成法も確立しています。
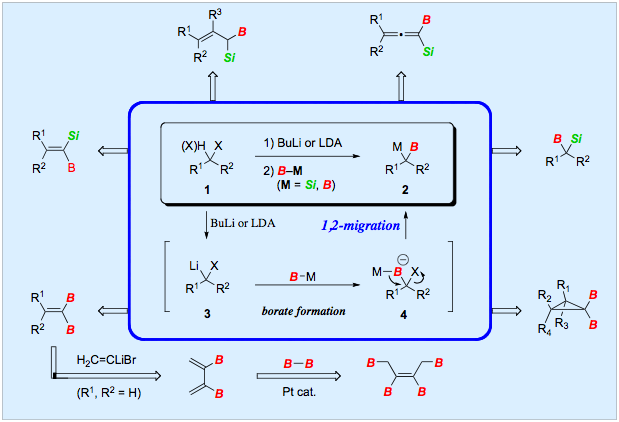
文献:Angew. Chem., Int. Ed. 2001, 40, 790-792; Angew. Chem., Int. Ed. 2001, 40, 4283-4286; Synlett 2001, 1006-1008; Tetrahedron 2002, 58, 6381-6395; Org. Lett. 2002, 5, 225-227; J. Organomet. Chem. 2003, 686, 286-293; Chem. Lett. 2006, 35, 1222-1223.
1−ボリル−1−シリル−2−アルケンのアルデヒド付加
アリル金属反応剤のアルデヒド付加反応は、鎖状立体制御法として有機合成における極めて重要な炭素−炭素結合生成反応の一つです。我々は、 gem−シリルホウ素化反応により調製容易な1−ボリル−1−シリル−2−アルケンがアリルボランとアリルシランのハイブリッド型反応剤とも見なせること、そして従来この二金属反応剤はアリルボランとしてしか利用されていなかったことに着目し、1−ボリル−1−シリル−2−アルケンをアリルシランとしてアルデヒドに付加させることに初めて成功しました。秘訣はルイス酸とベンジルシリルエーテルを使うことにより、オキソニウムイオン中間体を求電子剤として発生させる点です。この反応の立体選択性はたいへん高く、しかも興味深いことに熱的条件とは逆の立体選択性となっています。言い換えると、反応条件を工夫してアリル金属として働く金属種を使い分けることにより、立体異性体の作り分けが可能であることを明らかにしました。残る金属は、さらなる炭素−炭素結合伸張の手がかりとしてもちろん利用することができます。
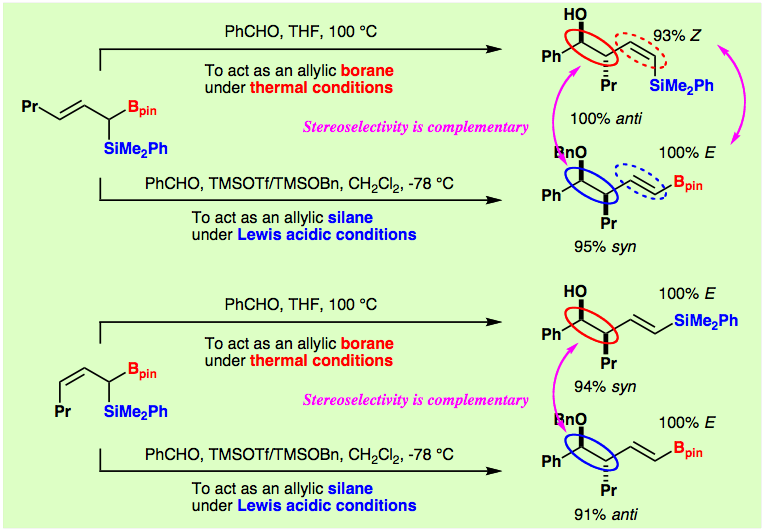
文献:Angew. Chem., Int. Ed. 2001, 40, 4283-4286.
2−アリール−1,1−ジボリル−1−アルケンの立体選択的交差カップリング反応の開発
非対称四置換オレフィンの立体選択合成は、たいへん難しく、有機合成におけるチャレンジングな課題の一つです。我々は、パラジウム触媒を用いて2−アリール−1,1−ジボリル−1−アルケンとヨウ化アリールを反応させると、アルキル基のシス位で100%立体選択的に交差カップリング反応が進行することを見つけました。そして、残るホウ素を使って2段目のカップリングを行うことにより、非ステロイド型抗エストロゲンの鍵構造の一つである1,1,2−トリアリール−1−アルケンが単一立体異性体として得られることを明らかにしました。この手法は、用いるヨウ化アリール二つの順番を逆にするだけで立体化学が逆のアルケンを合成することができます。さらに、二段階のカップリング反応を同一反応容器で一挙に行わせることも可能です。実際に、乳ガンの治療薬である(Z)-タモキシフェンをワンポット法で合成し、その有用性を例示しました。この四置換オレフィンの立体選択的合成法は、 Angewandte Chemie誌のHighlights (Angew. Chem. Int. Ed. 2006, 45, 2838–2840) に紹介されました。
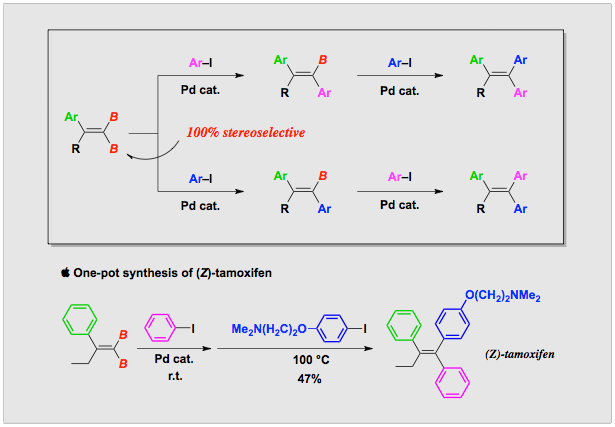
文献:J. Am. Chem. Soc. 2005, 127, 12506-12507; Synlett 2007, 1969-1971.
2,3−ジボリル−1,3−ブタジエンを用いる合成反応
2,3−ジボリル−1,3−ブタジエン1も交差カップリングを利用することにより、さまざまな有機分子へと変換することができます。たとえばヨウ化アリールと反応させると機能性ブタジエンポリマーのモノマーとして有用な2,3−ジアリール−1,3−ブタジエンに、ハロゲン化アルケニルとカップリングさせると交差共役系オレフィンであるデンドラレンに直截的に導くことができます。また、ハロゲン化ベンジル誘導体とのカップリングと続いて加水分解をおこなうことにより、抗マラリア・抗HIV性を有するアノリグナンBを極めて簡便に合成することも可能です。さらに、2,3−ジボリル−1,3−ブタジエン1はDiels–Alder反応のジエン成分としても有用です。内部アルキンとの環化付加生成物は、脱水素により芳香環化したあとカップリング反応を行うと、多置換ベンゼンに変換することができます。
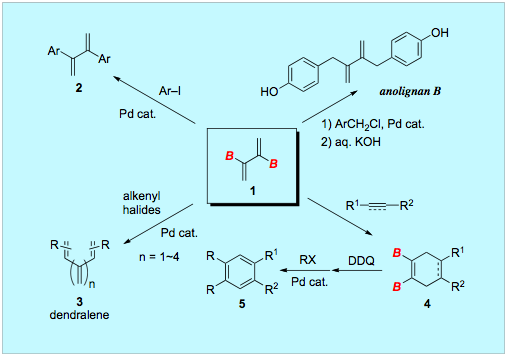
文献:Synlett 2001, 1006-1008; Chem. Lett. 2004, 33, 1066-1067; Chem. Asian J. 2007, 2, 1400-1408; Bull. Chem. Soc. Jpn. 2008, 81, 518-520.
テトラボリル−2−ブテンの三重アルデヒド付加
多段階にわたる反応を単一の実験操作により実現する反応(いわゆるカスケード反応)は、時間の短縮化、資源の省消費、廃棄物の削減につながるので、カスケード反応の開発は、経済的および環境保護の観点から、重要な課題です。我々は、テトラボリル−2−ブテンとアルデヒドの混合溶液を加熱すると、テトラボリル−2−ブテンとアルデヒド3分子が一挙に反応することを見つけました。得られる1,5−ジオールには不斉点が二つ、二重結合が一つ存在していますが、単一立体異性体として得られます。2,3−ジボリル−1,3−ブタジエンとジボロンからテトラボリル−2−ブテンを合成するプロセスとアルデヒドへの三重付加を、同一容器中単一の操作で一挙に行わせることにも成功しています。このときには、炭素−ホウ素結合を二つ形成する過程と炭素−ホウ素結合四つが炭素−炭素単結合二つと二重結合一つに変換する過程とが、完璧な立体選択性で連続して起こっていることになります。
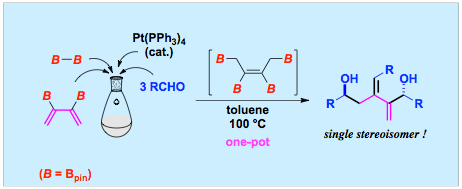
文献:Chem. Lett. 2006, 35, 838-839; Chem. Asian J. 2007, 2, 1142-1149.